- >Scientific productions
- >Thesis
- >Valentine Suteau thesis defence
Valentine Suteau thesis defence
The October 4, 2022
Ciblage pharmacologique des récepteurs couplés aux protéines G dans les tumeurs endocrines pour un repositionnement moléculaire– Exemple du cancer thyroïdien réfractaire à l’iode radioactif
Mardi 4 octobre - 14h - Amphitéâtre Ambroise Paré (faculté de médecine)
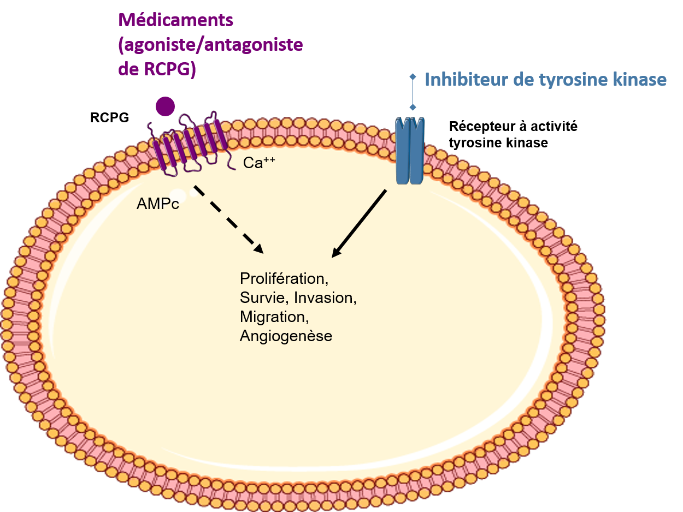
Introduction : Certaines tumeurs endocrines, dont les cancers de la thyroïde réfractaires à l'iode radioactif, ont des options thérapeutiques limitées. Le repositionnement de médicaments est une stratégie en développement en cancérologie. Les récepteurs couplés aux protéines G (RCPG) représentent la plus grande famille de récepteurs ciblés par des médicaments approuvés et de nombreuses données relient les RCPG au cancer. Nous avons donc cherché à identifier des médicaments ciblant les RCPG et ayant un effet antitumoral dans les tumeurs endocrines, en premier lieu dans le cancer thyroïdien réfractaire.
Méthodes : Nous avons analysé l’expression différentielle de près de 400 gènes codant pour des RCPG dans les tissus tumoraux en comparaison au tissu sain par analyse transcriptomique (technologie Nanostring) et/ou analyses bio-informatiques de bases de données (Gene Expression Omnibus et The Cancer Genome Atlas). Nous avons ensuite identifié les RCPG ciblés par des médicaments approuvés à partir de bases de données pharmacologiques (ChEMBL et DrugBank). Le criblage pharmacologique in vitro et ex vivo a été réalisé en quantifiant la viabilité cellulaire de 17 médicaments approuvés ciblant dix RCPG d’intérêt.
Résultats : Nos analyses transcriptomiques ont montré qu’un certain nombre de RCPG étaient sur ou sous-exprimés dans les tissus tumoraux en comparaison au tissu sain adjacent. Dix récepteurs ont été sélectionnés pour le criblage pharmacologique dans le cancer de la thyroïde, basés sur leur expression différentielle dans les cancers thyroïdiens, leur ciblage pharmacologique potentielle et un niveau d’expression suffisant au sein des lignées cellulaires étudiées (ADORA1, CHRM3, CXCR7, EDNRB, F2R, GABBR2, HRH1, HTR7, P2RY6, S1PR2). Celui-ci a montré que trois agents (Vilazodone, Vortioxetine, Fingolimod) avaient une efficacité anti-tumorale supérieure à 60% et une concentration inhibitrice de 50% (IC50) de l’ordre du micromolaire. Selon les sous-types histologiques, ces molécules avaient également un effet inhibiteur sur la migration et l’invasion.
Conclusion : Pour la première fois, nous avons établi le profil d'expression des RCPG dans les principales tumeurs endocrines avec des signatures spécifiques. Ces données pourraient aider à identifier des cibles thérapeutiques potentielles. Nous avons montré la faisabilité d’un criblage pharmacologique de médicaments ciblant les RCPG.
Pharmacological targeting of G protein coupled receptors in endocrine tumors for molecular repurposing - Example of Radioiodine refractory Thyroid Cancer
Introduction: Some endocrine tumors, including radioiodine refractory thyroid cancers, have limited therapeutic options. Drug repurposing is a developing strategy in oncology. G protein-coupled receptors (GPCRs) represent the largest family of receptors targeted by approved drugs and there is lot of evidence linking GPCRs to cancer. We therefore sought to identify GPCR-targeted drugs with antitumor effect in endocrine tumors, primarily in refractory thyroid cancer.
Methods: We analyzed the differential expression of about 400 genes encoding GPCRs in tumor tissues compared to healthy tissue by transcriptomic analysis (Nanostring technology) and/or bioinformatics analyses of databases (Gene Expression Omnibus (GEO) and The Cancer Genome Atlas (TCGA)). We then identified GPCRs targeted by approved drugs from pharmacological databases (ChEMBL and DrugBank). In vitro and ex vivo pharmacological screening was performed by quantifying cell viability of 17 approved drugs targeting ten selected GPCRs.
Results: Our transcriptomic analyses showed that a number of GPCRs were up- or downregulated in tumor tissue compared to adjacent healthy tissue. Ten receptors were selected for drug screening in thyroid cancer, based on their differential expression in thyroid cancers, their potential pharmacological targeting and a sufficient level of expression in the studied cell lines (ADORA1, CHRM3, CXCR7, EDNRB, F2R, GABBR2, HRH1, HTR7, P2RY6, S1PR2). This showed that three agents (Vilazodone, Vortioxetine, Fingolimod) had an anti-tumor efficacy greater than 60% and a 50% inhibitory concentration (IC50) in the micromolar range. Depending on the histological subtypes, these molecules also had an inhibitory effect on migration and invasion.
Conclusion : For the first time, we profiled the expression of GPCRs in major endocrine tumors with specific signatures. These data could help to identify potential therapeutic targets. We have shown the feasibility of drug screening of GPCR-targeted drugs


