- >Scientific productions
- >Events
- >Soutenance d'HDR du Dr Valérie Desquiret Dumas
Soutenance d'HDR du Dr Valérie Desquiret Dumas
The September 24, 2020
Jeudi 24 septembre 2020 à 10h.
Etude du rôle de la relation structure-fonction de la chaîne respiratoire mitochondriale dans les adaptations métaboliques cellulaires.
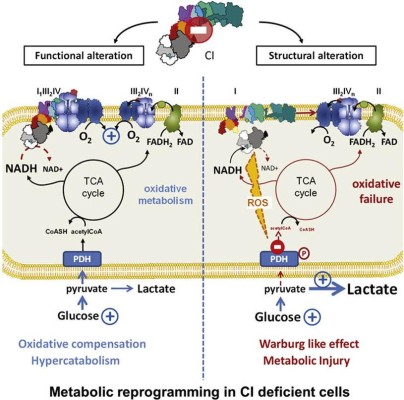
Pour s’adapter aux variations environnementales, la cellule doit posséder une flexibilité métabolique visant à ajuster la production énergétique en fonction de la disponibilité en substrats, en oxygène ou du stress oxydant. La synthèse d’ATP mitochondriale occupe une part centrale dans ce métabolisme énergétique. Cette dernière est finement régulée grâce à une coordination étroite entre l’expression des gènes de la chaîne respiratoire codés par le génome nucléaire et ceux codés par le génome mitochondrial. De nombreuses mutations dans ces gènes ont été découvertes ces dernières années et sont responsables d’un groupe hétérogène de pathologies héréditaires, les maladies mitochondriales. Dans ces pathologies, les défauts de fonctionnement mitochondrial se traduisent ainsi par une crise métabolique entraînant le plus souvent une réorientation du métabolisme vers la glycolyse et la mise en place d’un programme transcriptionnel visant à compenser ce déficit énergétique en augmentant la masse mitochondriale. Mes travaux de recherche passés et actuels s’articulent autour de cette détection du statut énergétique ainsi que de la communication nucléo-mitochondriale. Mes travaux récents se sont surtout focalisés sur le complexe I de la chaîne respiratoire. Une caractérisation biochimique et moléculaire de fibroblastes de patients porteurs de mutations dans des sous-unités de ce complexe nous a permis de mettre en évidence l’implication majeure de l’assemblage des sous-unités du complexe I dans la reprogrammation métabolique induite par le déficit énergétique dans ces cellules. Ainsi, nous avons mis à jour une voie de régulation induite par un désassemblage du complexe I impliquant les espèces réactives de l’oxygène et la protéine senseur du statut énergétique cellulaire, l’AMPK et conduisant à une inhibition de l’entrée du pyruvate dans la mitochondrie et une réorientation de ce métabolite vers la glycolyse en condition aérobie. Des travaux complémentaires de transcriptomique nous ont permis de dégager une signature moléculaire propre à ces fibroblastes présentant une reprogrammation métabolique lié au désassemblage du complexe I que ce soit au niveau de l’expression génique ou de longs ARN non codants. Mon projet de recherche actuel vise donc à préciser le rôle de ces longs ARN non codants dans les adaptations métaboliques mises en place suite à une carence énergétique mitochondriale non seulement dans les fibroblastes de patients porteurs de mutations mais également dans les cellules cancéreuses dans lesquelles une extinction du métabolisme oxydatif est couramment retrouvée.


